Contenido
Otras seccionesEn Quimica, electrones de valencia son los electrones que se encuentran en la capa de electrones más externa de un elemento. Saber cómo encontrar el número de electrones de valencia en un átomo en particular es una habilidad importante para los químicos porque esta información determina los tipos de enlaces químicos que puede formar y, por lo tanto, la reactividad del elemento. Afortunadamente, todo lo que necesitas para encontrar los electrones de valencia de un elemento es una tabla periódica estándar de los elementos.
Pasos
Parte 1 de 2: Encontrar electrones de valencia con una tabla periódica
Metales de no transición
Encontrar un Tabla periodica de los elementos. Esta es una tabla codificada por colores formada por muchos cuadrados diferentes que enumera todos los elementos químicos conocidos por la humanidad. La tabla periódica revela mucha información sobre los elementos; usaremos parte de esta información para determinar el número de electrones de valencia en el átomo que estamos investigando. Por lo general, puede encontrarlos dentro de la portada de los libros de texto de química. También hay una excelente mesa interactiva disponible en línea aquí.

Etiqueta cada columna de la tabla periódica de elementos del 1 al 18. Generalmente, en una tabla periódica, todos los elementos de una sola columna vertical tendrán el mismo número de electrones de valencia. Si su tabla periódica aún no tiene cada columna numerada, asigne a cada una un número que comience con 1 para el extremo izquierdo y 18 para el extremo derecho. En términos científicos, estas columnas se denominan elemento "grupos".- Por ejemplo, si estuviéramos trabajando con una tabla periódica donde los grupos no están numerados, escribiríamos un 1 sobre el hidrógeno (H), un 2 sobre el berilio (Be) y así sucesivamente hasta escribir un 18 sobre el helio (He). .

Encuentra tu elemento en la mesa. Ahora, ubique el elemento para el que desea encontrar los electrones de valencia en la tabla. Puede hacer esto con su símbolo químico (las letras en cada cuadro), su número atómico (el número en la parte superior izquierda de cada cuadro), o cualquier otra información disponible para usted en la tabla.- Por ejemplo, busquemos los electrones de valencia de un elemento muy común: carbono (C). Este elemento tiene un número atómico de 6. Está ubicado en la parte superior del grupo 14. En el siguiente paso, encontraremos sus electrones de valencia.
- En esta subsección, vamos a ignorar los metales de transición, que son los elementos en el bloque en forma de rectángulo formado por los Grupos 3 a 12. Estos elementos son un poco diferentes del resto, por lo que los pasos en esta subsección ganaron ' t trabajar en ellos. Vea cómo tratar con estos en la subsección a continuación.

Usa los números de grupo para determinar el número de electrones de valencia. El número de grupo de un metal que no es de transición se puede usar para encontrar el número de electrones de valencia en un átomo de ese elemento. los el lugar de las unidades del número de grupo es el número de electrones de valencia en un átomo de estos elementos. En otras palabras:- Grupo 1: 1 electrón de valencia
- Grupo 2: 2 electrones de valencia
- Grupo 13: 3 electrones de valencia
- Grupo 14: 4 electrones de valencia
- Grupo 15: 5 electrones de valencia
- Grupo 16: 6 electrones de valencia
- Grupo 17: 7 electrones de valencia
- Grupo 18: 8 electrones de valencia (excepto el helio, que tiene 2)
- En nuestro ejemplo, dado que el carbono está en el grupo 14, podemos decir que un átomo de carbono tiene cuatro electrones de valencia.
Metales de transición
Encuentre un elemento de los Grupos 3 a 12. Como se señaló anteriormente, los elementos de los grupos 3 a 12 se denominan "metales de transición" y se comportan de manera diferente al resto de los elementos cuando se trata de electrones de valencia. En esta sección, explicaremos cómo, hasta cierto punto, a menudo no es posible asignar electrones de valencia a estos átomos.
- Por ejemplo, escojamos el tantalio (Ta), elemento 73. En los siguientes pasos, encontraremos sus electrones de valencia (o, al menos, tratar a.)
- Tenga en cuenta que los metales de transición incluyen la serie de lantánidos y actínidos (también llamados "metales de tierras raras"), las dos filas de elementos que generalmente se colocan debajo del resto de la tabla que comienzan con lantano y actinio. Todos estos elementos pertenecen a grupo 3 de la tabla periódica.
Comprenda que los metales de transición no tienen electrones de valencia "tradicionales". Comprender por qué los metales de transición realmente no "funcionan" como el resto de la tabla periódica requiere una pequeña explicación de la forma en que los electrones se comportan en los átomos. Vea a continuación un resumen rápido u omita este paso para ir directo a las respuestas.
- A medida que se agregan electrones a un átomo, se clasifican en diferentes "orbitales", básicamente áreas diferentes alrededor del núcleo en las que se congregan los electrones. Generalmente, los electrones de valencia son los electrones en la capa más externa, en otras palabras, los últimos electrones agregados. .
- Por razones que son demasiado complejas para explicarlas aquí, cuando se agregan electrones a la re capa de un metal de transición (más sobre esto a continuación), los primeros electrones que entran en la capa tienden a actuar como electrones de valencia normales, pero después de eso, no lo hacen, y los electrones de otras capas orbitales a veces actúan como electrones de valencia. Esto significa que un átomo puede tener varios electrones de valencia dependiendo de cómo se manipule.
Determina el número de electrones de valencia según el número de grupo. Una vez más, el número de grupo del elemento que está examinando puede indicarle sus electrones de valencia. Sin embargo, para los metales de transición, no hay un patrón que pueda seguir; el número de grupo generalmente corresponderá a un rango de posibles números de electrones de valencia. Estos son:
- Grupo 3: 3 electrones de valencia
- Grupo 4: 2 a 4 electrones de valencia
- Grupo 5: 2 a 5 electrones de valencia
- Grupo 6: 2 a 6 electrones de valencia
- Grupo 7: 2 a 7 electrones de valencia
- Grupo 8: 2 o 3 electrones de valencia
- Grupo 9: 2 o 3 electrones de valencia
- Grupo 10: 2 o 3 electrones de valencia
- Grupo 11: 1 o 2 electrones de valencia
- Grupo 12: 2 electrones de valencia
- En nuestro ejemplo, dado que el tantalio está en el grupo 5, podemos decir que tiene entre dos y cinco electrones de valencia, dependiendo de la situación.
Parte 2 de 2: Encontrar electrones de valencia con una configuración electrónica
Aprenda a leer una configuración electrónica. Otra forma de encontrar los electrones de valencia de un elemento es con algo llamado configuración electrónica. Estos pueden parecer complicados al principio, pero son solo una forma de representar los orbitales de los electrones en un átomo con letras y números y son fáciles una vez que sabes lo que estás mirando.
- Veamos una configuración de ejemplo para el elemento sodio (Na):
- 1s2s2p3s
- Tenga en cuenta que esta configuración electrónica es solo una cadena repetida que es así:
- (número) (letra) (número) (letra) ...
- ...y así. los (número) (letra) chunk es el nombre del orbital del electrón y es el número de electrones en ese orbital, ¡eso es todo!
- Entonces, para nuestro ejemplo, diríamos que el sodio tiene 2 electrones en el orbital 1s más 2 electrones en el orbital 2s más 6 electrones en el orbital 2p más 1 electrón en el orbital 3s. Eso es 11 electrones en total; el sodio es el elemento número 11, por lo que tiene sentido.
- Tenga en cuenta que cada subcapa tiene una cierta capacidad de electrones. Sus capacidades de electrones son las siguientes:
- s: capacidad de 2 electrones
- p: capacidad de 6 electrones
- d: capacidad de 10 electrones
- f: 14 electrones de capacidad
- Veamos una configuración de ejemplo para el elemento sodio (Na):
Encuentre la configuración electrónica del elemento que está examinando. Una vez que conoces la configuración electrónica de un elemento, encontrar su número de electrones de valencia es bastante simple (excepto, por supuesto, para los metales de transición). Si te dan la configuración desde el principio, puedes pasar al siguiente paso. Si tiene que encontrarlo usted mismo, consulte a continuación:
- Examine la configuración electrónica completa para el oganesson (Og), elemento 118, que es el último elemento de la tabla periódica. Tiene la mayor cantidad de electrones de cualquier elemento, por lo que su configuración electrónica demuestra todas las posibilidades que podría encontrar en otros elementos:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Ahora que tiene esto, todo lo que necesita hacer para encontrar la configuración electrónica de otro átomo es simplemente completar este patrón desde el principio hasta que se quede sin electrones. Esto es más fácil de lo que parece. Por ejemplo, si queremos hacer el diagrama orbital del cloro (Cl), elemento 17, que tiene 17 electrones, lo haríamos así:
- 1s2s2p3s3p
- Observe que el número de electrones suma 17: 2 + 2 + 6 + 2 + 5 = 17. Solo necesita cambiar el número en el orbital final; el resto es el mismo ya que los orbitales antes del final están completamente llenos .
- Para obtener más información sobre configuraciones electrónicas, consulte también este artículo.
- Examine la configuración electrónica completa para el oganesson (Og), elemento 118, que es el último elemento de la tabla periódica. Tiene la mayor cantidad de electrones de cualquier elemento, por lo que su configuración electrónica demuestra todas las posibilidades que podría encontrar en otros elementos:
Asigne electrones a las capas orbitales con la regla del octeto. A medida que se agregan electrones a un átomo, caen en varios orbitales de acuerdo con el orden indicado anteriormente: los dos primeros entran en el orbital 1s, los dos siguientes entran en el orbital 2s, los seis siguientes entran en el orbital 2p y pronto. Cuando se trata de átomos fuera de los metales de transición, decimos que estos orbitales forman "capas orbitales" alrededor del núcleo, y que cada capa sucesiva está más alejada que las anteriores. Además de la primera capa, que solo puede contener dos electrones, cada capa puede tener ocho electrones (excepto, nuevamente, cuando se trata de metales de transición). Regla del octeto.
- Por ejemplo, digamos que estamos mirando el elemento Boro (B). Dado que su número atómico es cinco, sabemos que tiene cinco electrones y su configuración electrónica se ve así: 1s2s2p. Dado que la primera capa orbital tiene solo dos electrones, sabemos que el boro tiene dos capas: una con dos electrones 1s y otra con tres electrones de los orbitales 2s y 2p.
- Como otro ejemplo, un elemento como el cloro (1s2s2p3s3p) tendrá tres capas orbitales: una con dos electrones 1s, una con dos electrones 2s y seis electrones 2p, y una con dos electrones 3s y cinco electrones 3p.
Encuentre el número de electrones en la capa más externa. Ahora que conoce las capas de electrones de su elemento, encontrar los electrones de valencia es fácil: simplemente use la cantidad de electrones en la capa más externa. Si la capa exterior está llena (en otras palabras, si tiene ocho electrones o, para la primera capa, dos), el elemento es inerte y no reaccionará fácilmente con otros elementos. Una vez más, sin embargo, las cosas no siguen estas reglas para los metales de transición.
- Por ejemplo, si estamos trabajando con boro, dado que hay tres electrones en la segunda capa, podemos decir que el boro tiene Tres electrones de valencia.
Utilice las filas de la tabla como atajos de shell orbital. Las filas horizontales de la tabla periódica se denominan elemento "períodos". Comenzando desde la parte superior de la tabla, cada período corresponde al número de capas de electrones los átomos en el período poseen. Puede usar esto como un atajo para determinar cuántos electrones de valencia tiene un elemento; simplemente comience desde el lado izquierdo de su período al contar electrones. Una vez más, querrá ignorar los metales de transición con este método, que incluye los grupos 3-12.
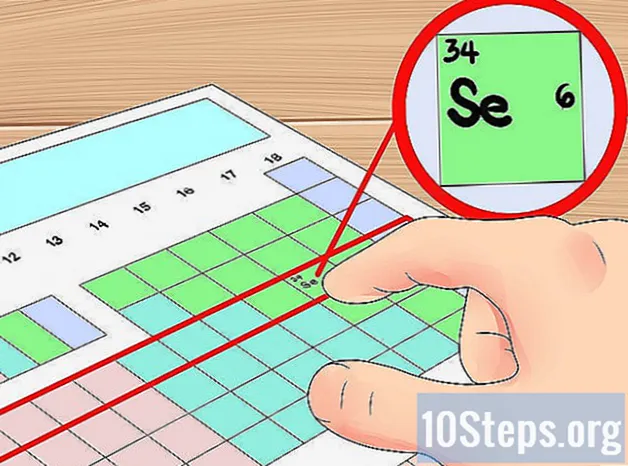
- Por ejemplo, sabemos que el elemento selenio tiene cuatro capas orbitales porque está en el cuarto período. Dado que es el sexto elemento de la izquierda en el cuarto período (ignorando los metales de transición), sabemos que la cuarta capa exterior tiene seis electrones y, por lo tanto, el selenio tiene seis electrones de valencia.
Preguntas y respuestas de la comunidad
¿Cómo calculamos el electrón de valencia?
Los electrones de valencia se pueden encontrar determinando las configuraciones electrónicas de los elementos. A partir de entonces, el número de electrones en la capa más externa da el número total de electrones de valencia en ese elemento.
Si un átomo tiene 33 electrones, ¿cuántos electrones de valencia hay?
Si el átomo no es un ion, entonces podemos decir que el átomo tiene 33 protones. Esto significa que es el elemento 33, que es arsénico. Entonces sabemos que no es un metal de transición, por lo que buscamos y encontramos que el dígito unitario de su número de grupo es 5, lo que significa que tiene 5 electrones de valencia.
¿Cómo determino el número atómico del helio?
El número de protones es igual al número atómico.
¿Por qué los electrones ganan carga negativa y no carga positiva?
Los átomos ganan o pierden electrones, cargas negativas, porque los protones tienen carga positiva y se mantienen en el núcleo por la fuerza nuclear fuerte. Esta es una de las cuatro fuerzas distintas del Universo: gravedad, electromagnetismo, la fuerza débil y la fuerza nuclear fuerte. Tiene que ser fuerte porque los protones se repelen entre sí, pero están muy juntos en el núcleo (junto con los neutrones, también sostenidos por la fuerza fuerte). La idea es que la fuerza fuerte es extremadamente fuerte pero solo en distancias muy pequeñas. Piense en pequeños ganchos súper fuertes. Para que los protones y neutrones se conecten, se necesitan fuerzas como la inmensa gravedad de una estrella, una supernova o una explosión nuclear.
¿Cuál es el electrón de cenefa de los gases nobles?
Los gases nobles tienen ocho electrones de valencia, el estado más estable de un elemento.
¿Por qué el nitrógeno tiene 6 electrones de cenefa pero está en el grupo 15?
El nitrógeno tiene solo cinco electrones de valencia porque está en el grupo 5, aunque en realidad está en el grupo 15, ignorará los metales de transición porque estos grupos tienen diferentes formas de determinar sus electrones de valencia. Por lo tanto: grupo 13 significa grupo 3 y así sucesivamente.
Un átomo tiene 7 protones, 8 neuronas y 7 electrones. ¿Cuál es la cantidad de electrones en su capa de valencia?
El elemento que contiene 7 protones es el nitrógeno. El nitrógeno está en la columna de elementos que tiene 5 electrones en la capa de valencia. El número de neutrones es irrelevante para encontrar el número de electrones de valencia en un elemento específico.
¿En qué parte de la tabla periódica se encuentran los átomos con siete electrones de la capa exterior?
Mire en la penúltima columna del lado derecho, junto a los gases inertes.
¿Qué es un electrón de valencia?
Un electrón de valencia es un electrón que se encuentra en la parte más externa de un átomo y se puede compartir o tomar en una reacción.
¿Por qué los elementos de la tabla periódica tienen diferentes números de electrones de valencia?
Tienen diferentes estructuras químicas. Los electrones de valencia son los que crean reacciones químicas.
Consejos
- Tenga en cuenta que las configuraciones de electrones se pueden escribir en una especie de taquigrafía utilizando gases nobles (los elementos del grupo 18) para reemplazar los orbitales al comienzo de la configuración. Por ejemplo, la configuración electrónica del sodio se puede escribir 3s1; esencialmente, es lo mismo que el neón, pero con un electrón más en el orbital 3s.
- Los metales de transición pueden tener subcapas de valencia que no están completamente llenas. La determinación del número exacto de electrones de valencia en metales de transición implica principios de la teoría cuántica que están más allá del alcance de este artículo.
- Tenga en cuenta que las tablas periódicas difieren de un país a otro. Por lo tanto, verifique que esté utilizando el correcto y actualizado para evitar confusiones.
- Asegúrese de saber cuándo sumar o restar del último orbital para encontrar electrones de valencia.
Cosas que necesitará
- Tabla periodica de los elementos
- Lápiz
- Papel
Todos los días en wikiHow, trabajamos arduamente para brindarte acceso a instrucciones e información que te ayudarán a vivir una vida mejor, ya sea para mantenerte más seguro, más saludable o para mejorar tu bienestar. En medio de la actual crisis económica y de salud pública, cuando el mundo está cambiando drásticamente y todos estamos aprendiendo y adaptándonos a los cambios en la vida diaria, la gente necesita wikiHow más que nunca. Tu apoyo ayuda a wikiHow a crear artículos y videos ilustrados más detallados y a compartir nuestra marca confiable de contenido instructivo con millones de personas en todo el mundo. Considere hacer una contribución a wikiHow hoy.