Contenido
- etapas
- Método 1 Equilibrar una ecuación por el método de prueba y error
- Método 2 Equilibrar una ecuación por el método algebraico
En química, una ecuación establece lo que sucedió durante una reacción química. A la izquierda de la ecuación, colocamos los reactivos que se usaron para el experimento y a la derecha, los productos obtenidos durante el experimento. De acuerdo con el principio de conservación de la masa (Lavoisier) durante una reacción química, no desaparece ningún átomo, no se crea ninguno, se combinan de manera diferente. En resumen, debe tener el mismo número de datos de cada elemento a la derecha que a la izquierda de la ecuación. Es por eso que una ecuación de equilibrio siempre debe ser equilibrada.
etapas
Método 1 Equilibrar una ecuación por el método de prueba y error
-
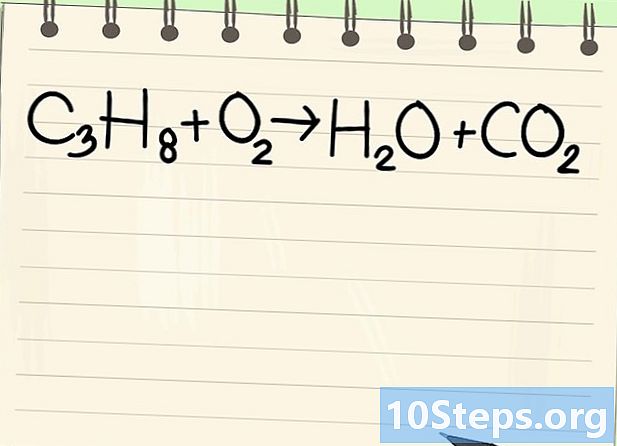
Tenga en cuenta la ecuación de equilibrio. Trataremos la siguiente ecuación:- C3H8 + O2 -> H2O + CO2
- Esta es la ecuación de la combustión de propano (C3H8) en oxígeno: se obtienen agua y dióxido de carbono.
-
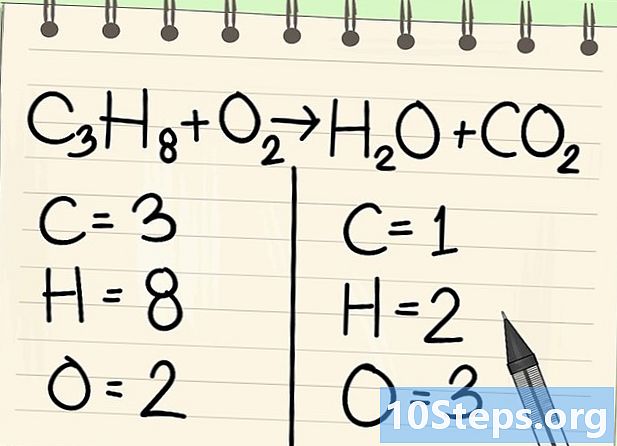
Cuenta los átomos. Ingrese el número de datoms de cada elemento en un lado de la ecuación, luego en el otro. Para esto, tenga en cuenta los índices, si no hay ninguno, el índice es 1.- A la izquierda, hay 3 átomos de carbono, 8 de hidrógeno y 2 de oxígeno.
- A la derecha, hay 1 átomo de carbono, 2 de hidrógeno y 3 de oxígeno.
-
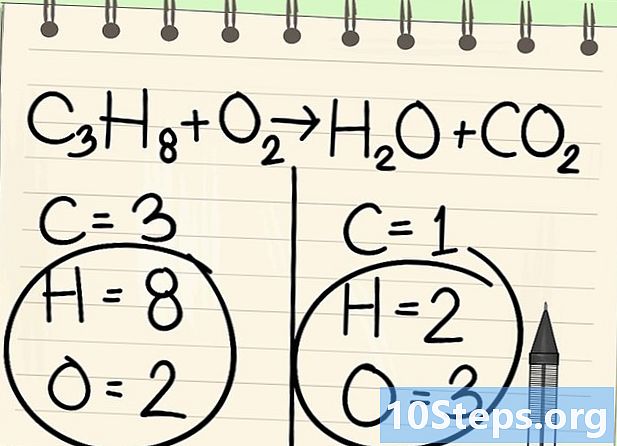
Deje de lado momentáneamente el hidrógeno y el oxígeno. -

Comience a equilibrar con el elemento correcto. Siempre comenzamos con el de una molécula antes y después de la reacción. Si hay varios, tome el monovalente en una de las moléculas. Aquí comenzamos con los átomos de carbono. -

Equilibra los átomos de carbono. Agregue, a la derecha, un coeficiente a la molécula de dióxido de carbono (CO2) en el que el latome de carbono está solo. Pondremos un 3 para obtener los 3 átomos izquierdos.- C3H8 + O2 -> H2O + 3Colorado2
- Así tenemos 3 átomos de carbono a la derecha gracias al coeficiente (3CO2) y 3 átomos de carbono a la izquierda gracias al índice (C3H8).
- En una ecuación, puede poner todos los coeficientes que desee, pero no puede tocar las pistas.
-
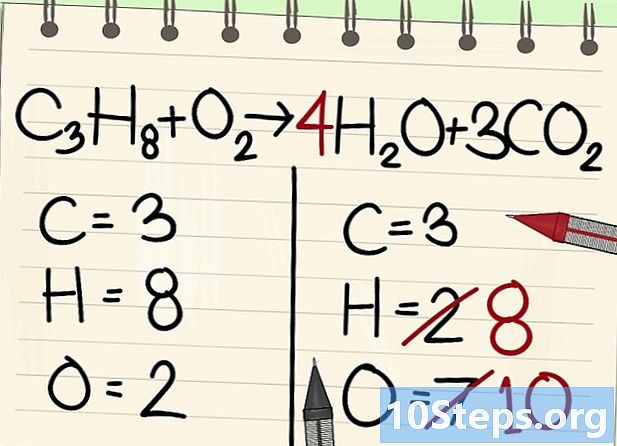
Equilibra los átomos de hidrógeno. Como te quedan 8 de la ecuación, necesitas tanto derecho.- C3H8 + O2 --> 4H2O + 3CO2
- A la derecha, colocará un coeficiente de 4, porque el hidrógeno es bivalente en la molécula de agua: el índice 2 indica que dos átomos de hidrógeno están asociados.
- Para obtener el número de átomos de hidrógeno a la derecha, multiplique el coeficiente 4 por el índice 2 u 8 átomos.
- En cuanto a los átomos de oxígeno, a la derecha, ahora hay 6 en un lado, provenientes de las tres moléculas de 3CO2 (3 x 2 = 6 átomos) y 4 de las 4 moléculas de 4 H2O (4 x 1 = 4 átomos), es decir, un total de 10 átomos de oxígeno.
-
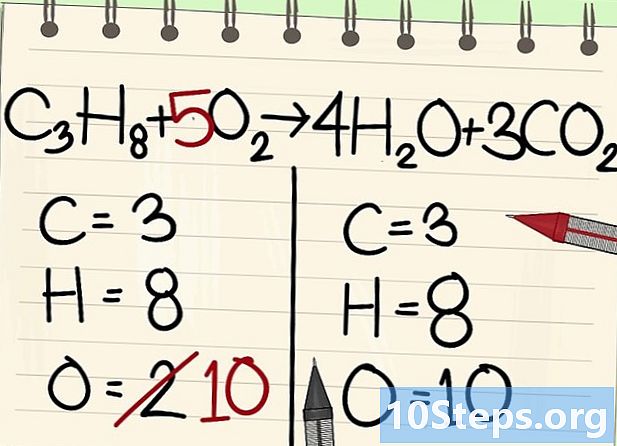
Equilibra los átomos de oxígeno.- Debido al equilibrio de carbono e hidrógeno, el número de átomos de oxígeno no es el mismo en ambos lados de la ecuación. Vimos anteriormente que había 10 átomos de oxígeno a la derecha (4 de las moléculas de agua y 6 de las moléculas de dióxido de carbono). A la izquierda, solo hay 2 (de O2).
- Para equilibrar el oxígeno, agregue un coeficiente de 5 a la molécula de oxígeno izquierda: tiene 10 átomos de oxígeno a la izquierda y el otro a la derecha.
- C3H8 + 5O2 -> 4H2O + 3CO2
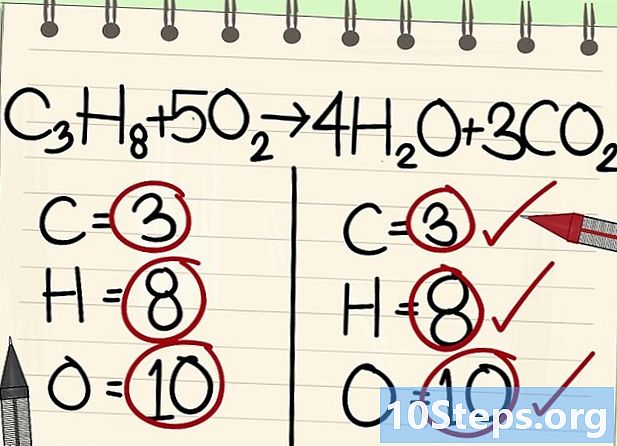
- Todos los átomos (carbono, hidrógeno y oxígeno) están equilibrados: su ecuación está equilibrada.
Método 2 Equilibrar una ecuación por el método algebraico
-

Escribe la ecuación para equilibrar. Asigne a cada molécula un coeficiente literal. Los llamaremos tiene, b, c y d. -
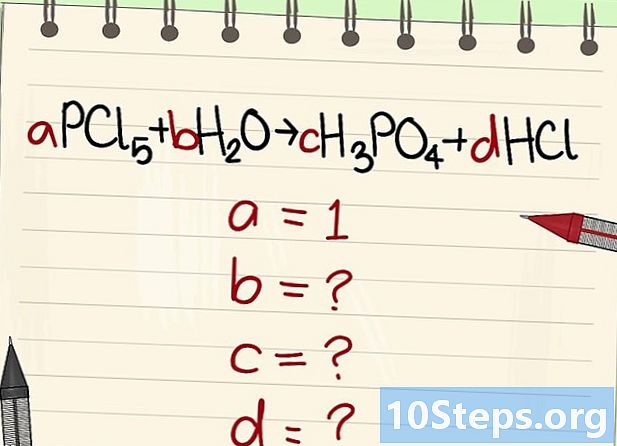
Encuentre el valor de los otros coeficientes literales. Preguntaremos eso tiene = 1. -

Encuentra las relaciones entre estos coeficientes. Mirando a la izquierda (reactivos) y a la derecha (productos), establezca las relaciones entre estos diferentes coeficientes.- Tome la siguiente ecuación: aPCl5 + bH2O = cH3PO4 + dHCl. Se ha dicho que a = 1, lo que significa que c = a, d = 5a y 2b = 3c + d. Cálculos realizados, c = 1, d = 5 yb = 4.

- Tome la siguiente ecuación: aPCl5 + bH2O = cH3PO4 + dHCl. Se ha dicho que a = 1, lo que significa que c = a, d = 5a y 2b = 3c + d. Cálculos realizados, c = 1, d = 5 yb = 4.