Contenido
Otras seccionesEl hidrógeno es el elemento más ligero y tiene muchos usos industriales, incluida la creación de grasas hidrogenadas para su uso en la cocina y la producción de hidrocarburos a partir del carbón. Es una parte esencial de las moléculas de agua y se puede separar con una pequeña cantidad de electricidad. También puede producir gas hidrógeno utilizando algunos metales activos y ácidos fuertes. Ambos métodos son relativamente simples y le permitirán recolectar gas hidrógeno.
Pasos
Método 1 de 2: uso de desplazamiento de agua con metales activos
Reúna los materiales necesarios. Para recolectar hidrógeno usando la reacción de mezclar un ácido fuerte con un metal activo, necesitará: un matraz Erlenmeyer, un tapón de goma, tubos de plástico, agua destilada, tubos de ensayo, un recipiente grande, ácido clorhídrico (HCl) 3 molar y pellets de magnesio o zinc.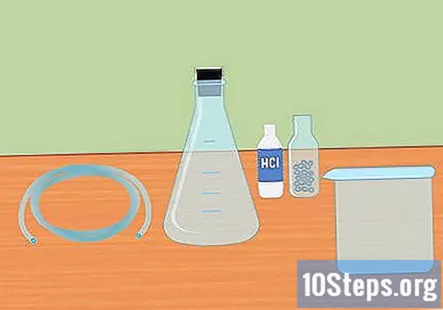
- Un matraz Erlenmeyer es un matraz de vidrio que tiene un fondo cónico y un cuello cilíndrico.
- El tapón de goma es para la parte superior del matraz y debe tener un orificio en el medio para que pase el tubo.
- Tanto el magnesio como el zinc funcionarán para este experimento, no necesita ambos.
- Es posible que deba comprar algunos de estos suministros en línea o en una tienda de suministros de laboratorio.

Use equipo de protección adecuado. Cuando trabaje con un ácido fuerte como el ácido clorhídrico, debe asegurarse de tomar las precauciones de seguridad adecuadas. Es esencial usar una bata de laboratorio, guantes, zapatos cerrados y protección para los ojos.- Las gafas deben envolver los lados de los ojos para protegerlos de las salpicaduras.
- Use guantes que le queden bien para mantener una buena destreza de sus manos y dedos.
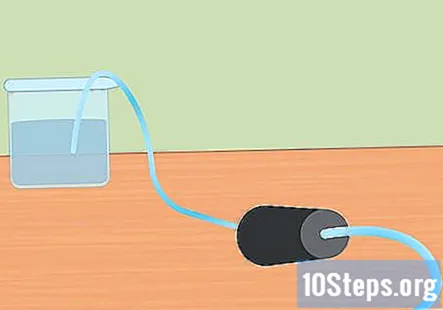
Prepare la configuración experimental. Inserte un extremo del tubo en el orificio del tapón de goma. Desea que el tubo pase por el tapón de goma y sobresalga ligeramente del extremo. Llene el recipiente grande con agua y coloque el extremo libre del tubo en el agua. Cuando comience el experimento, colocará el tapón de goma en el matraz Erlenmeyer.- Deja estas piezas a un lado hasta que estés listo para usarlas.
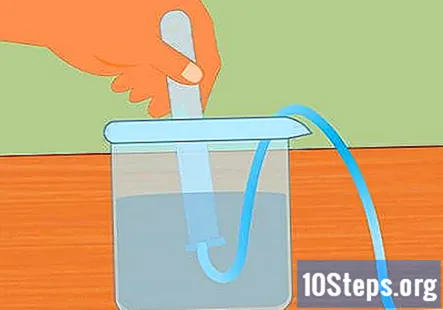
Sumerge el tubo de ensayo en el agua. Tome al menos un tubo de ensayo (puede usar más si desea recolectar más hidrógeno) y sumérjalo en el agua. Incline el tubo para que todas las burbujas de aire puedan escapar. Coloque el tubo encima del tubo sumergido unido al tapón de goma en el extremo opuesto.- Es esencial que se eliminen todas las burbujas de aire del tubo antes de comenzar. De lo contrario, el gas recogido en el tubo será más que hidrógeno.
Agregue ácido clorhídrico al matraz Erlenmeyer. Agregue suficiente ácido clorhídrico para llenar el matraz hasta la mitad. Aproximadamente 100 ml deberían ser suficientes. Asegúrese de que el matraz esté limpio y seco antes de agregar el ácido. Use guantes de goma y tenga cuidado al llenar el matraz.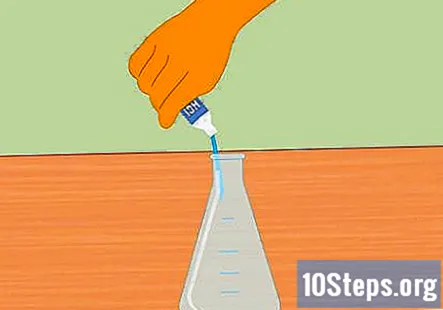
- Tenga cuidado de no derramar agua en el ácido. El agua agregada al ácido puede provocar una explosión y lesiones.
Inicie la reacción química agregando gránulos de metal a HCl. Agregue un puñado de gránulos de zinc o magnesio al ácido clorhídrico en el matraz. La cantidad exacta que ponga no es importante, pero un puñado pequeño debería ser suficiente para iniciar la reacción.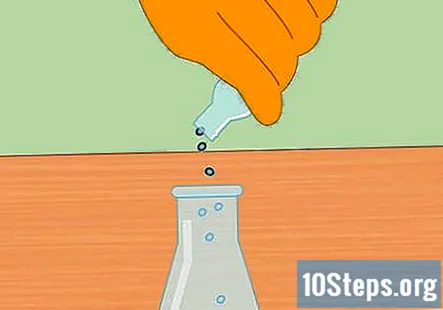
- Después de agregar los gránulos, coloque el tapón en el matraz para que el sistema ahora esté cerrado.
Recoge el hidrógeno en un tubo de ensayo sumergido. A medida que el metal reacciona con el ácido, se produce hidrógeno gaseoso. Este hidrógeno viaja a la parte superior del matraz, a través del tubo y al tubo de ensayo sumergido en el agua. El gas desplazará el agua y debería ver que se forma una burbuja en la parte superior del tubo de ensayo.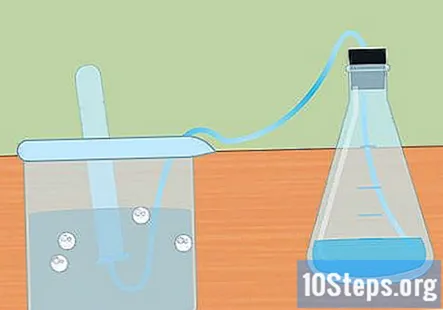
- Cuando el tubo de ensayo se llene de hidrógeno, sumerja otro tubo en agua y colóquelo sobre el tubo. Puede recolectar tanto hidrógeno como sea producido por su reacción.
- Mantenga los tubos de ensayo hacia abajo para evitar que el gas hidrógeno se escape al aire.
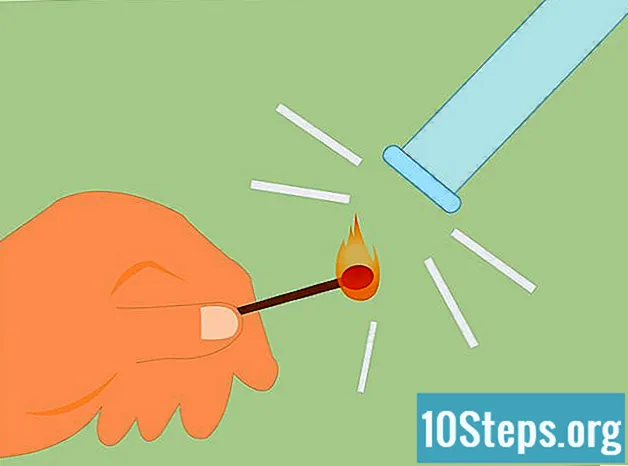
Confirme que el gas sea hidrógeno. Para confirmar que el gas es hidrógeno, puede hacer lo que se llama prueba de férula. Enciende un fósforo y mantenlo debajo del tubo. Oirá un "pop" o un chirrido, lo que indica que hay hidrógeno presente.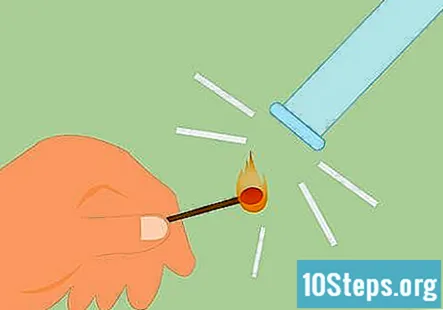
Método 2 de 2: uso de electrólisis
Reúna los materiales necesarios. En este experimento, utilizará electricidad para separar los gases de hidrógeno y oxígeno de las moléculas de agua. Para recolectar gas hidrógeno mediante electrólisis, necesitará una batería de 9 voltios, un lápiz, dos tubos de ensayo, un recipiente de plástico, agua, bicarbonato de sodio, dos bandas de goma grandes (opcionales) y un clip de batería con abrazaderas en el extremo.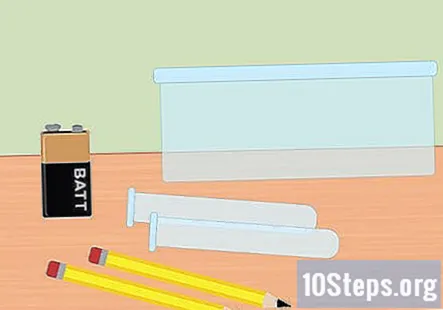
- El lápiz debe tener grafito para que esto funcione. Un lápiz del número 2 es perfecto. Dos pequeños trozos de grafito también funcionarán para esto.
- Un recipiente o tazón pequeño para almacenar alimentos es suficiente.
- Asegúrese de que el clip de la batería se ajuste a una batería de 9 voltios y que tenga un cable rojo y negro con pinzas de cocodrilo en el extremo. Estas abrazaderas se utilizarán para conectar su sistema a la batería.
Retire el borrador del lápiz y parta el lápiz por la mitad. Necesita dos piezas de grafito, una para el extremo positivo de la batería y para el extremo negativo de la batería. Afila ambos extremos de cada pieza del lápiz hasta un punto. Asegúrese de que el grafito esté bien expuesto.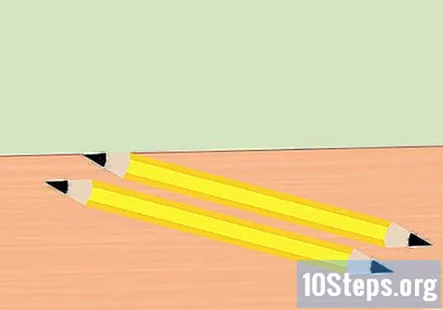
- Este paso se puede omitir si ya tiene dos piezas de grafito puro.
Envuelva 2 bandas de goma alrededor del recipiente en forma de X. Este paso es opcional, pero es una manera fácil de mantener los tubos de ensayo en su lugar mientras se realiza el experimento. Estire una banda elástica sobre el recipiente y estire una segunda banda elástica sobre él para que cruce sobre la primera, formando una X.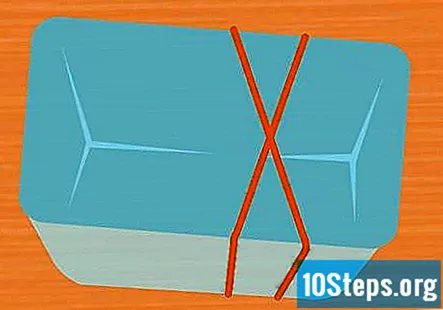
- Si no usa bandas de goma, asegúrese de asegurar los tubos de ensayo con cinta o cuerda para que permanezcan boca abajo durante el experimento.
Prepara una solución de agua y bicarbonato de sodio. Disolver bicarbonato de sodio en agua ayudará a que la electricidad se conduzca en el sistema. La cantidad exacta de bicarbonato de sodio agregado no es importante, pero aproximadamente 1 cucharadita por 1 taza de agua debería ser suficiente. Revuelva hasta que esté completamente disuelto.
- Use agua tibia para acelerar la disolución del bicarbonato de sodio.
Llene el recipiente de plástico y los tubos de ensayo con la solución de bicarbonato de sodio. El recipiente debe ser lo suficientemente grande para contener ambos tubos de ensayo. Agregue suficiente solución para llenar el recipiente aproximadamente en tres cuartas partes. Sumerja los tubos de ensayo en la solución del recipiente y déles la vuelta. Coloque cada tubo en la cruz de la banda elástica X para mantenerlo en su lugar.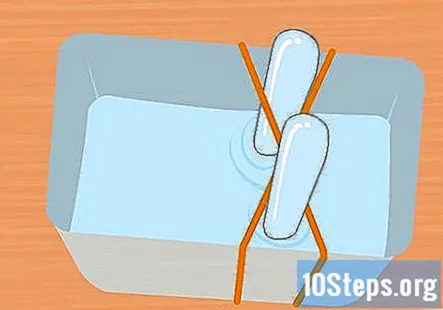
- Es muy importante que ambos tubos de ensayo estén completamente llenos de agua y no queden burbujas de aire.
Fije las abrazaderas de cocodrilo al grafito. Tome una abrazadera del clip de la batería y fíjela al extremo de uno de los lápices. Asegúrese de que toque tanto grafito como sea posible. Haz lo mismo con la pinza de cocodrilo restante y la pieza de lápiz.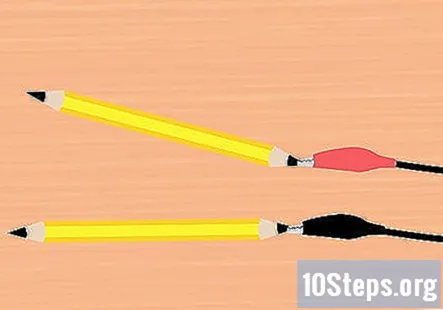
- Se debe colocar un lápiz en la abrazadera roja y un lápiz en la abrazadera negra.
Desliza el extremo sin sujetar del lápiz en el tubo de ensayo. Manteniendo el tubo de ensayo completamente sumergido, inclínelo ligeramente para que pueda deslizar el extremo sin sujetar del lápiz en el tubo. Repite este proceso con el otro lápiz y el otro tubo de ensayo.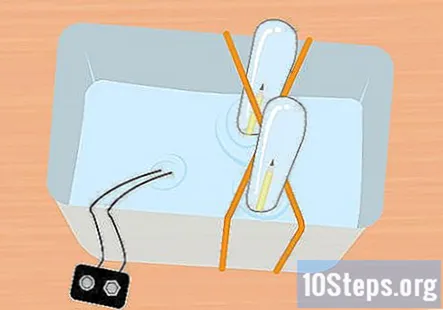
- En este punto, todo debe estar bajo el agua y debe haber un lápiz dentro de cada tubo de ensayo.
- Mantenga el extremo del clip de la batería que se fija a la batería fuera del agua.
Coloque el clip de la batería en la batería de 9 voltios. Con todo configurado, ahora está listo para aplicar la electricidad proporcionada por la batería de 9 voltios. El extremo del clip de la batería debe sobresalir del contenedor, así que simplemente coloque la batería en su lugar. Una vez que la batería está colocada, debería notar burbujas que se elevan desde el extremo del grafito y flotan hacia la parte superior de cada tubo de ensayo.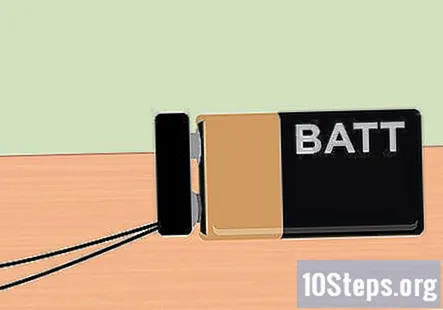
- Si no ve que se produzcan burbujas, verifique que las abrazaderas de cocodrilo estén firmemente unidas al grafito del lápiz. Además, verifique que su batería esté completamente cargada.
- El tubo de ensayo con el cable negativo conectado al lápiz producirá hidrógeno, mientras que el tubo de ensayo conectado al cable positivo de la batería producirá oxígeno.
Recolecte hidrógeno y oxígeno en los dos tubos de ensayo hasta que tenga unas pocas pulgadas de gas en cada tubo. Recuerde, el tubo conectado al extremo negativo de la batería tendrá el hidrógeno y el oxígeno estará en el tubo conectado al extremo positivo. Saque los tubos de ensayo del frasco, uno a la vez. Manténgalos boca abajo y deje que el agua se escurra. El gas en los tubos permanecerá aunque no pueda verlo.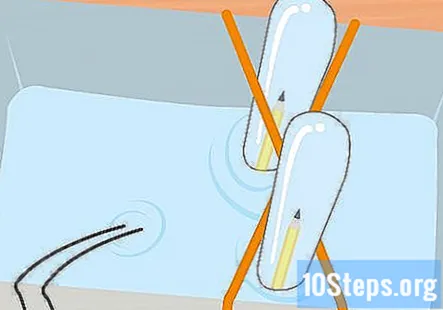
Prueba la presencia de hidrógeno. Puede probar la presencia de hidrógeno encendiendo un fósforo y sosteniendo la llama hacia el gas. Hará un sonido de "chirrido" muy distinto si es hidrógeno. También puede usar una vela encendida en lugar de un fósforo.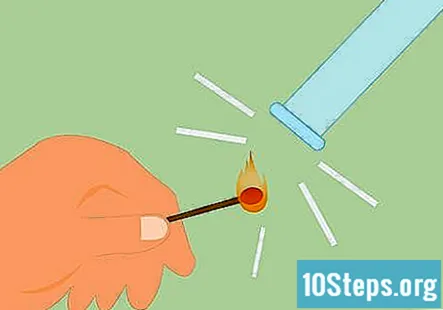
- Para probar el oxígeno en el tubo de ensayo que estaba conectado al lado positivo de la fuente de energía, apague una cerilla encendida (o vela) y coloque el extremo aún encendido debajo del tubo de ensayo. Si la vela se vuelve a encender, hay oxígeno.
Preguntas y respuestas de la comunidad
¿Necesito dos tubos de ensayo si solo quiero recolectar hidrógeno?

La científica ambiental Bess Ruff es una estudiante de doctorado en geografía en la Universidad Estatal de Florida. Recibió su Maestría en Ciencias Ambientales y Gestión de la Universidad de California, Santa Bárbara en 2016. Ha realizado trabajos de encuesta para proyectos de planificación espacial marina en el Caribe y ha brindado apoyo de investigación como becaria de posgrado para el Grupo de Pesca Sostenible.

¿Cuánto hidrógeno se puede recolectar de este simple experimento de electrólisis? ¿Y cuál sería la presión del gas hidrógeno?
Eso depende. La velocidad de la reacción (división del agua) se basa en los amperios de la batería y el tiempo restante para reaccionar. Por lo general, el hidrógeno se encuentra aproximadamente a la presión del nivel del mar, a menos que realice el experimento en un ambiente realmente cálido o frío.
¿Por qué se acumula el hidrógeno en el tubo negativo?
Debido a la forma en que las moléculas de agua comparten electrones, los átomos de hidrógeno tienen carga positiva y los átomos de oxígeno tienen carga negativa. Al extraer los gases, el hidrógeno cargado positivamente será atraído hacia el tubo negativo, mientras que el oxígeno cargado negativamente será atraído hacia el tubo positivo.
¿Por qué el gas no escapó de mi tubo colector de gas?
Es hidrógeno, un gas que es más ligero que todos los demás, incluido el helio, lo que significa que permanecerá en el tubo de ensayo mientras el extremo cerrado del tubo esté en la parte superior porque los otros gases lo desplazan. La razón por la que usamos helio en lugar de hidrógeno es que no es inflamable. Esto se debe al hecho de que es un gas noble (tiene una capa de valencia completa de 8 electrones) y, por lo tanto, no es reactivo.
¿El gas sería muy inflamable?
Si. Vea el desastre de Hindenburg en YouTube. Los zepelines usaban hidrógeno debido a que era el gas más ligero y bastante fácil de obtener. También es la razón por la que algunos fabricantes de automóviles están trabajando en automóviles propulsados por hidrógeno.
¿Es esta la forma líquida del hidrógeno?
No, el hidrógeno de este experimento será gaseoso.
¿Cómo licito el hidrógeno? Responder
Advertencias
- Tenga cuidado con el hidrógeno puro. Es altamente explosivo cuando se mezcla con aire.
- Asegúrese de que se haya eliminado todo el aire del equipo en el que está recolectando hidrógeno.