Autor:
Mike Robinson
Fecha De Creación:
7 Septiembre 2021
Fecha De Actualización:
11 Mayo 2024
Contenido
El número atómico corresponde al número de protones en el núcleo de un solo átomo de un elemento. Este valor no cambia; por lo tanto, puede usarlo para descubrir otras características del isótopo, como el número de neutrones.
Pasos
Parte 1 de 2: Encontrar el número atómico
Encuentra una copia de la tabla periódica. Haga clic aquí si no tiene uno disponible. Cada elemento tiene su propio número atómico; por lo tanto, no hay atajos para aprender el contenido. Utilice una copia de la tabla o intente memorizarla.
- La mayoría de los libros de química tienen la tabla impresa en la contraportada.

Encuentra el elemento que estás estudiando en la tabla. La mayoría de las tablas incluyen el nombre completo de los elementos, así como sus símbolos (Hg para mercurio, por ejemplo). Si no puede encontrar lo que está buscando, conéctese en línea y realice una búsqueda con los términos "símbolo químico" y el nombre del elemento.
Encuentra el número atómico del elemento. Suele estar en la esquina superior izquierda o derecha de la casa del elemento, pero también puede venir en otros lugares. Además, siempre es un valor entero.- Si el número incluye un punto decimal, probablemente indica la masa atómica.
Confirma la información según los elementos cercanos. La tabla periódica está organizada según el orden de los números atómicos. Si su número de isótopo es "33", por ejemplo, el elemento de la izquierda será "32" y el de la derecha será "34". En ese caso, es porque estás mirando el número atómico.
- Hay un salto entre los elementos "56" (bario) y "88" (radio). Los isótopos que corresponden a este rango están en las dos filas debajo de la tabla. Solo se separan así para que la mesa no sea demasiado grande.

Comprende lo que significa el número atómico. El número atómico tiene una definición simple: la cantidad de protones en un átomo del elemento. Esta cantidad de protones, a su vez, determina la carga eléctrica total del núcleo, que, en consecuencia, determina cuántos electrones puede cargar el átomo. Dado que los electrones son responsables de casi todas las interacciones químicas, el número atómico afecta indirectamente las propiedades físicas y químicas del elemento.- En otras palabras, cada átomo con ocho protones corresponde a un átomo de oxígeno. Dos átomos de oxígeno pueden tener diferentes números de neutrones o (si uno es un ion) o electrones, pero siempre tendrán ocho protones cada uno.
Parte 2 de 2: Descubrir información más importante
Determina el peso atómico. Por lo general, aparece bajo el nombre del elemento en la tabla periódica y tiene dos o tres lugares decimales. El peso atómico corresponde a la masa promedio de los átomos de un elemento, que representa cómo se encuentra en la naturaleza. Se mide en "unidades de masa atómica" ("u" o "u.m.a").
- Muchos científicos prefieren utilizar el término "masa atómica" en lugar de peso.
Comprende la masa atómica. El concepto de masa atómica es muy similar al de peso. La diferencia es que el peso indica la masa promedio de cualquier átomo en el elemento, no un átomo específico. Por ejemplo: un gramo de hierro contiene varios átomos con masas variables; el peso indica su "masa relativa". Si estudia un solo átomo del elemento, solo necesita conocer su masa específica.
- Generalmente, los problemas de química que involucran solo átomos ya informan el número de masa atómica. Solo necesita comprender el concepto para no ser tomado por sorpresa cuando vea un valor diferente.
Redondea el número de masa. El número de masa corresponde a la cantidad total de protones y neutrones en un átomo del elemento. No es difícil calcularlo: simplemente tome la masa atómica impresa en la tabla periódica y redondeela al valor entero más cercano.
- Esto funciona porque las cantidades de neutrones y protones están muy cerca de 1 u.m.a., mientras que la de electrones está muy cerca de cero. La masa atómica implica cálculos exactos para determinar el valor decimal, pero los únicos datos que importan son los números enteros, que le dicen cuántos protones y neutrones hay.
- Recuerde que si usa masa atómica, va a meterse con el peso de un átomo específico en un elemento. Una muestra de bromo, por ejemplo, tiene una masa atómica de 79 u 81.
Calcula la cantidad de neutrones. Ahora, ya sabe que el número atómico es igual al número de protones y que el número másico es igual a la suma del número de protones y neutrones. Para determinar la cantidad de neutrones en un elemento, simplemente reste el número atómico de esa masa total. Algunos ejemplos:
- Un átomo de helio (He) tiene un número másico de 4 y un número atómico de 2. Por lo tanto, 4 - 2 = 2 neutrones.
- Una muestra de plata (Ag) tiene un número de masa promedio de 108 (según la tabla periódica) y un número atómico de 47. En promedio, cada átomo de la muestra tiene 108 - 47 = 61 neutrones.
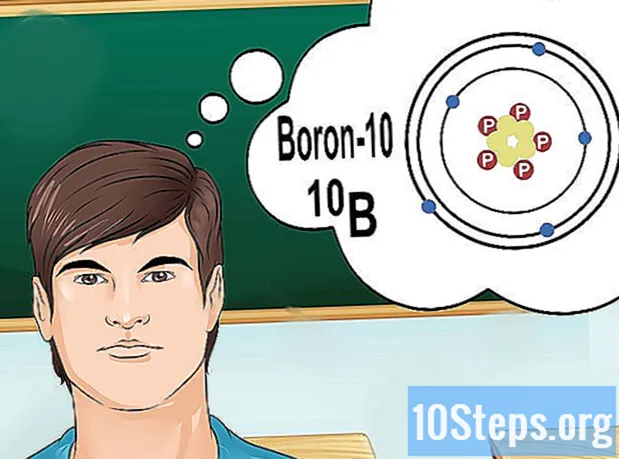
Comprende los isótopos. Un isótopo es una forma específica de un elemento que contiene varios neutrones. Si el problema que quieres resolver trae algo como "boro-10" o "B", es porque estás hablando de los elementos de boro con el número de masa 10. Usa este valor, no los valores "normales" de boro.
- El número atómico de isótopos nunca cambia. Cada isótopo de un elemento tiene el mismo número de protones.
Consejos
- El peso atómico de algunos elementos más pesados viene entre paréntesis o corchetes. Esto significa que este peso es la masa exacta del isótopo más estable, no un promedio de varios isótopos. Finalmente, esto no afecta el número atómico del elemento.